Produção de hidrogênio (H₂) a partir da eletrólise da água.
Publicado em 30 de Novembro de 2025 às 13:59

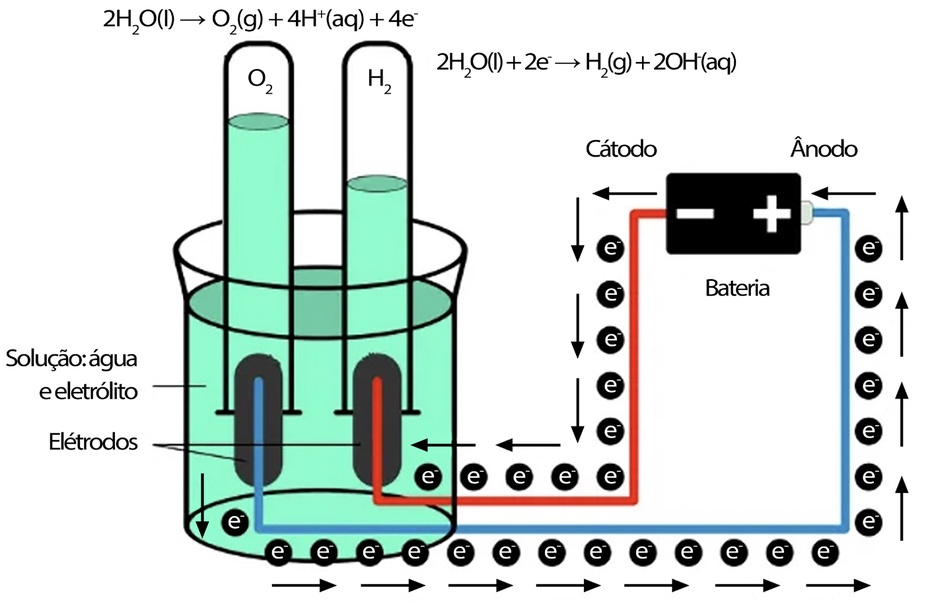
O projeto de hidrogênio responsável consiste em produzir hidrogênio gasoso (H₂) a partir da eletrólise da água. Nesse processo, a eletricidade separa a água em hidrogênio e oxigênio sem emitir CO₂, tornando-o uma alternativa limpa para substituir combustíveis fósseis.
O hidrogênio verde pode ser usado para armazenar energia, mover veículos (células a combustível), abastecer indústrias pesadas (como siderurgia e fertilizantes) e ajudar na descarbonização global. É considerado uma das tecnologias-chave para enfrentar as mudanças climáticas por reduzir emissões e permitir energia renovável em larga escala.
Materiais Necessários
- -Fonte de alimentação DC regulável (0–12 V), capaz de fornecer 0–2 A (para demonstração). Por exemplo uma fonte de bancada.
- -Recipiente transparente (becker de +-500 mL)o qual vai permitir ver bolhas.
- -Eletrodos ( um par): preferencialmente aço inoxidável. (alternativas: fitas de aço inoxidável ou eletrodos comerciais. Evite alumínio/cobre (corroem)).
- -Fios com jacaré/isolamento.
- -Eletrólito leve: 1–2 g/L de bicarbonato de sódio (NaHCO₃) como opção segura para iniciação; (se souber manusear com PPE pode usar eletrólitos alcalinos (KOH/NaOH) para maior corrente/eficiência).
- -Dois tubos de ensaio para coletar os gases.
- -Béquer com água destilada (melhor controle da condutividade) e indicador de pH caso queira monitorar.
Ferramentas Necessárias
- -EPIs como óculos, luvas nitricas e jaleco.
Etapas
Segurança!!!
-
-O hidrogênio é inflamável em mistura com ar. Trabalhe somente em ambiente bem ventilado (exterior preferível) e longe de fontes de chama/faíscas. Use os EPIs que já mencionei.
-Projeto destinado a pequenas quantidades educativas. Não tente escalar para produção industrial nem armazenar grandes volumes de H₂ em recipientes improvisados. (serio!!!)
-Use eletrólitos suaves (bicarbonato de sódio) para demonstrações; hidróxidos fortes (NaOH/KOH) aumentam eficiência mas são corrosivos e exigem precauções extras.
Procedimento passo a passo
-
1-Preparar local seguro: superfície não inflamável, ventilação e extintor por perto. Desligue a fonte antes de conectar.
2-Preparar solução: encha o béquer com +-200 a 300 mL de água destilada e dissolva entre 0,2–0,6 g de bicarbonato de sódio (aprox. 1–2 g/L) (apenas o suficiente para melhorar condutividade sem tornar a solução corrosiva.) Mexa até dissolver. (Se usar NaOH/KOH, siga procedimentos de PPE e instruções do fabricante.)
3- Fixar eletrodos: prenda os dois eletrodos nas laterais do béquer, paralelos e separados por +-4 cm (não se tocarem). Isole conexões para evitar curto.
4-Conectar fonte: conecte o polo positivo (+) a um eletrodo (Ânodo) e o negativo (−) ao outro (cátodo). Mantenha a fonte desligada enquanto conecta. Depois ligue em baixa tensão (por exemplo 3 V) e aumente até obter bolhas visíveis.
5-Observação/Coleta: no cátodo formam-se bolhas de H₂; no ânodo O₂ (isto é 2:1 em volume H₂:O₂). Se quiser coletar, coloque um frasco invertido preenchido com água sobre o eletrodo e capture o gás por deslocamento.
6-Desligar e descarte: ao terminar, desligue a fonte antes de remover eletrodos!. Descarte solução conforme regulamentos locais; águas com apenas bicarbonato são inofensivas em geral, (soluções com NaOH/KOH requerem neutralização e descarte seguro.)
Em geral é isso! simples porém deve ser feito com responsabilidade!.
Caso queira pode fazer o cálculo de rendimento
-
Fórmula básica: quantidade de substância é proporcional à carga elétrica total. Faraday ≈ 96.485 C/mol.
Para formar 1 mol de H₂ são necessários 2 mol de elétrons (2·F coulombs).
Exemplo:
se passar 1 A por 1 hora → carga Q = 1 A × 3600 s = 3600 C. Moles H₂ = Q / (2·F) = 3600 / (2·96485) ≈ 0,01866 mol. Volume (STP) ≈ 0,01866 × 22,414 L ≈ 0,42 L H₂.
Portanto, 1 A por 1 h produz ~0,42 L H₂ (STP) ordem de grandeza útil para planejamento de demos.
(Cálculo conforme exemplo em fontes sobre Faraday)
Problemas comuns: e agora?
-
Poucas bolhas / corrente baixa: verificar conexões, aumentar ligeiramente a concentração do eletrólito (com cuidado) ou tensão; verificar se óxidos/camada passiva nos eletrodos estão bloqueando contato.
Eletrodos corroendo rapidamente: pode estar usando metal inadequado (ex.: alumínio) ou eletrólito muito agressivo; troque para inox ou reduza concentração.
Água turva / odores: interrompa o experimento! pode haver subproduto da corrosão, descarte e troque água/eletrodos.
Referenciais
-
Atkins, P.; Jones, L. Princípios de Química: Questionando a Vida Moderna e o Meio Ambiente. Bookman.
*(Eletrólise, reações de oxirredução e fundamentos de hidrogênio.)
outros:
DOE - H2 Educate Student Guide (material educacional sobre eletrólise e segurança).
NYSERDA - lição prática sobre eletrólise (guia de atividade escolar, materiais e segurança).
EIGA - Guideline for Small Scale Hydrogen Production (normas de segurança para pequenas plantas).
ChemGuide / Purdue - cálculos de Faraday e fundamentos de eletrólise.
dúvidas? questões ou dicas me envie em roxadelli.g.v@gmail.com
Conclusão
O projeto mostrou que a eletrólise é um método simples e eficiente para produzir hidrogênio a partir da água, permitindo observar a formação dos gases e entender as reações químicas envolvidas. Também evidenciou que, quando alimentado por energia renovável, esse processo se torna uma alternativa limpa e importante para o desenvolvimento do hidrogênio verde e para a transição energética sustentável.



Comentários
0